Hintergrund:
Das Neugeborenen-Screening dient der Früherkennung angeborener metabolischer und endokriner Störungen, die unbehandelt zu letalen Krisen oder Langzeitschäden führen können. In Deutschland ist das Neugeborenen-Screening in der Kinder-Richtlinie des Gemeinsamen Bundesausschusses (G-BA) geregelt. Qualitätsberichte werden jährlich von der Deutschen Gesellschaft für Neugeborenen-Screening (DGNS-Report) erstellt und publiziert. Die Daten der DGNS-Reporte 2006–2018 sind Grundlage dieser Arbeit.
Methode:
Für die Jahre 2006–2018 wurden die Prävalenzen berechnet und Daten zur Prozessqualität ausgewertet.
Ergebnis:
Unter 9 218 538 Geburten wurden 6 917 Neugeborene mit einer Zielkrankheit identifiziert. Die Gesamtprävalenz liegt bei 75 von 100 000 Neugeborenen, wobei die konnatale Hypothyreose mit 30 von 100 000 gefolgt von Phenylketonurie (PKU) und Medium-Chain-Acyl-CoA-Dehydrogenase-(MCAD)-Mangel mit jeweils 10 von 100 000 am häufigsten gefunden werden. Von 272 205 angeforderten Kontrolluntersuchungen gingen 80 % ein. Die Rate der positiven Screening-Befunde (Recall) sank im untersuchten Zeitraum von 0,90 % im Jahr 2006 auf 0,37 % im Jahr 2018. Bei jedem fünften positiven Screening-Befund bestätigte sich eine Zielkrankheit. Innerhalb von zwei Wochen wurde bei 79 % der Kinder mit Therapieindikation eine Behandlung begonnen.
Schlussfolgerung:
Die niedrige Recall-Rate und der frühe Behandlungsbeginn bei 79 % der betroffenen Kinder sprechen für die Effektivität des Programms. Die Einbindung von Tracking-Strukturen und die Einführung eines Registers könnten die Qualität des Programms weiter verbessern.
Das Neugeborenen-Screening auf angeborene Stoffwechsel- und Hormonstörungen ist eine der erfolgreichsten Maßnahmen der Sekundärprävention im Kindesalter. Bereits seit Ende der 1960er Jahre werden Neugeborene auf Phenylketonurie (PKU) gescreent, seit den 1980er Jahren zusätzlich auf Hypothyreose und Galaktosämie. Im Jahr 2004 nahm der Gemeinsame Bundesausschuss (G-BA) das sogenannte „Erweiterte Neugeborenen-Screening“ (ENS) auf zwölf Zielkrankheiten in die Kinder-Richtlinie und damit in die Regelversorgung auf und ergänzte es 2018 um Tyrosinämie Typ I sowie 2019 um schwere kombinierte Immundefekte (SCID) (1). Mit gesonderten Regelungen wurde das Mukoviszidose-Screening 2016 eingeführt (2).
Einige Zielkrankheiten können bereits früh zu lebensbedrohlichen Stoffwechselkrisen oder zu bleibenden Schäden führen. Demzufolge ist das Ziel des ENS, möglichst alle betroffenen Kinder frühzeitig zu erkennen, gleichzeitig aber nur wenige Familien gesunder Kinder durch einen falsch-positiven (auffälligen) Befund zu beunruhigen (3). Dafür ist ein standardisierter Ablauf mit festgelegten Verantwortlichkeiten erforderlich; dieser Ablauf wird mit der Kinder-Richtlinie für Aufklärung und Einwilligung, Durchführung und Inhalte des Screenings sowie Laborleistungen vorgegeben (1, 2). Nicht geregelt sind hingegen die Erfassung der Konfirmationsdiagnostik, die Evaluation des Screenings und das Tracking. Letzteres soll sicherstellen, dass auffällige oder wiederholungsbedürftige Befunde kontrolliert werden.
Methoden
Verantwortlich für die Durchführung des Neugeborenen-Screenings ist der Leistungserbringer, der die Geburt des Kindes verantwortlich geleitet hat. Vor der Blutentnahme müssen die Eltern über das Neugeborenen-Screening, in der Regel von einer ärztlichen Person, entsprechend den Vorgaben des Gendiagnostikgesetzes (4) aufgeklärt werden und schriftlich einwilligen. Natives Blut soll zwischen der 36. und 72. Lebensstunde entnommen, auf ein spezielles Filterpapier getropft, getrocknet und in ein Screening-Labor geschickt werden. Bei Entlassung vor 36 Lebensstunden soll ein Früh-Screening in der Geburtseinrichtung abgenommen werden. Bei diesen Kindern und bei Frühgeborenen, bei denen die erste Probe vor 32 Schwangerschaftswochen (SSW) entnommen wurde, ist eine Kontrolluntersuchung nach 36 Lebensstunden beziehungsweise mit 32 SSW obligatorisch.
Ein positiver Screening-Befund (Recall) stellt eine Verdachtsdiagnose dar und muss umgehend weiter abgeklärt werden. In Abhängigkeit von der Ausprägung des positiven Befunds und der Verdachtsdiagnose wird die Wiederholung des Screenings oder die direkte Abklärung (Konfirmationsdiagnostik) in einem spezialisierten Zentrum empfohlen.
Nach der Kinder-Richtlinie haben die Labore jährlich einen Qualitätsbericht abzugeben, der für alle deutschen Screening-Labore als Nationaler Screening-Report von der Deutschen Gesellschaft für Neugeborenen-Screening e. V. (DGNS) erstellt und öffentlich zugänglich unter www.screening-dgns.de/reports.php publiziert wird (5). Die Labore melden der DGNS kumulative Daten zur Prozessqualität und pseudonymisierte Individualdaten zur Konfirmationsdiagnostik. Die Daten werden auf Plausibilität geprüft und die Fälle anhand von definierten Kriterien validiert. Die positiv validierten Fälle sowie Fälle ohne Angaben zur Konfirmationsdiagnostik, bei denen wiederholte Screening-Werte („eindeutiges Neugeborenen-Screening“) mit sehr hoher Wahrscheinlichkeit für die Richtigkeit der Verdachtsdiagnose sprechen, werden für die Berechnung der Prävalenzen auf die in Deutschland gemeldeten Geburten bezogen.
Für diese Publikation wurden die Daten der DGNS-Reporte 2006–2018 (5) herangezogen und aufgearbeitet. Die Daten zum Mukoviszidose-Screening liegen erst ab 2016 vor. Sie werden gesondert publiziert werden, da hier ein komplexer Screening-Algorithmus zum Einsatz kommt, dessen Darstellung mit den sich hieraus ergebenden Problemen den Rahmen dieser Publikation sprengen würde. Die statistische Auswertung erfolgte mit SPSS 25.
Ergebnisse
In Deutschland haben derzeit elf Labore die Genehmigung zur Erbringung und Abrechnung des Neugeborenen-Screenings. Für Bayern ist zusätzlich ein von den Laboren unabhängiges Screening-Zentrum im Bayerischen Landesamt für Gesundheit und Lebensmittelsicherheit zur Sicherstellung einer hohen Prozessqualität und zur Evaluation des Screenings eingebunden (6, 7, 8, 9) (eKasten 1). Alle Daten und Berechnungen dieser Publikation beziehen sich, wenn nicht anders angegeben, auf den gesamten Zeitraum von 2006–2018.
Kasten
Qualitätsparameter im Neugeborenen-Screening
Bild vergrößernAlle Bilder
eKasten 1
Strukturelle Organisation des deutschen Neugeborenen-Screenings
Bild vergrößernAlle Bilder
Gesamtzahlen
Bei einem Populations-Screening hängt der Erfolg wesentlich von einer hohen Teilnahmerate ab, die mit 9 244 411 dokumentierten Screening-Untersuchungen bei 9 218 538 Geburten (10) in Deutschland erreicht wurde. Die höhere Zahl an Untersuchungen erklärt sich unter anderem durch Proben von nicht in Deutschland gemeldeten Kindern. Insgesamt wurden 8 471 Ablehnungen des gesamten ENS (1 von 1 000 Neugeborenen) dokumentiert.
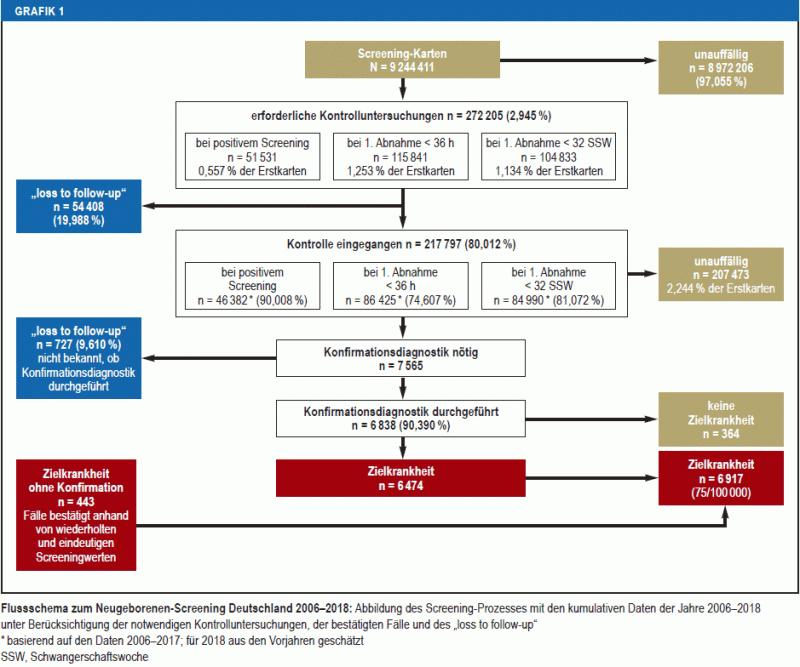
Von den Laboren wurden bei 30 von 1 000 Kindern (n = 272 205) Kontrolluntersuchungen (Zweitkarten) angefordert; die meisten wegen einer Blutabnahme vor 36 Lebensstunden (13 von 1 000; n = 115 841) oder vor SSW 32 (11 von 1 000; n = 104 833). Eine Kontrolle nach positivem Screening-Befund (Recall) war bei 51 531 Neugeborenen erforderlich (6 von 1 000) und erfolgte bei 90,01 % der Kinder. Insgesamt wurden 80,01 % (n = 217 797) der angeforderten Kontrolluntersuchungen durchgeführt (Grafik 1).
Grafik 1
Flussschema zum Neugeborenen-Screening Deutschland 2006–2018
Bild vergrößernAlle Bilder
Prozesszeiten
Entscheidend für die Effektivität des Neugeborenen-Screenings sind kurze Prozesszeiten, um eine möglichst frühe Behandlung der betroffenen Kinder zu erreichen (3). Eine Blutentnahme vor 72 Lebensstunden trägt wesentlich dazu bei und erfolgte 2018 bei 96,22 % der Neugeborenen (eGrafik 1, eKasten 2). Dies ist ein Anstieg um 13,85 % gegenüber 2006. Im Gegensatz dazu ist der Anteil an Blutproben, bei denen mehr als zwei Tage zwischen der Blutentnahme und dem Eingang im Labor liegen, von 42,08 % im Jahr 2006 auf 51,64 % im Jahr 2018 angestiegen (eGrafiken 2 und 3).
eGrafik 1
Alter bei Blutabhahme 2006–2018
Bild vergrößernAlle Bilder
eGrafik 2
Zeitspanne von Blutabnahme bis Laboreingang
Bild vergrößernAlle Bilder
eGrafik 3
Zeitspanne vom Laboreingang bis zur Befundmitteilung
Bild vergrößernAlle Bilder
eKasten 2
Entwicklungen der Prozesszeiten 2006–2018 im Hinblick auf eine frühzeitige Diagnosestellung
Bild vergrößernAlle Bilder
Bei 6 014 der 6 917 Kinder mit bestätigter Diagnose war eine Behandlung nötig, die bei 3 127 Neugeborenen (51,95 %) innerhalb von einer und bei weiteren 1 627 Kindern (27,05 %) in der zweiten Lebenswoche begonnen wurde. Damit wurden innerhalb von zwei Wochen nach Geburt 79,05 % der betroffenen Neugeborenen therapiert (Median Therapiebeginn = 7 Lebenstage). Bei 778 Kindern wurde die Behandlung später begonnen, darunter 342 (43,96 %) Kinder mit Hypothyreose, 124 (15,94 %) mit MCAD-Mangel (MCAD, Medium-Chain-Acyl-CoA-Dehydrogenase) und 145 (18,64 %) mit Biotinidasemangel (zum Teil partiell). Der Anteil der Kinder mit spätem Behandlungsbeginn bleibt über die Jahre konstant, ebenso der Anteil der Kinder, bei dem der Behandlungsbeginn nicht bekannt ist (n = 482; 8,02 %). Bei 901 Kindern mit milder Hyperphenylalaninämie bestand keine Therapieindikation, zwei sehr unreife Frühgeborene waren vor Therapiebeginn verstorben (eGrafik 4).
eGrafik 4
Alter bei Therapiebeginn
Bild vergrößernAlle Bilder
Prävalenz
Die Prävalenz von seltenen angeborenen Erkrankungen ist abhängig von der ethnischen Zusammensetzung der Screening-Population und kann erst bei hohen Fallzahlen valide berechnet werden. Im vorliegenden Datensatz wurde für 6 917 Neugeborene, das heißt für 75 von 100 000, eine Zielkrankheit dokumentiert (Tabelle 1).
Tabelle 1
Zielkrankheiten im deutschen Neugeborenen-Screening 2006–2018; Vergleich der Prävalenz mit Schätzungen aus dem Jahr 2004
Bild vergrößernAlle Bilder
Bei 37 Kindern mit unauffälligem (falsch-negativem) Screening-Ergebnis wurde aufgrund klinischer Symptome eine Zielkrankheit diagnostiziert und der Befund dem Screening-Labor mitgeteilt (8 Kinder mit adrenogenitalem Syndrom, 29 Kinder mit Hypothyreose). Dies sind Einzelmeldungen, da in Deutschland kein Register existiert, in dem alle Erkrankungsfälle dokumentiert werden.
Analytische Qualität
Die Güte eines Testverfahrens (Kasten) wird anhand der Sensitivität, der Spezifität sowie des positiven Vorhersagewerts (PPV) bestimmt. Der PPV beschreibt die Wahrscheinlichkeit, mit der sich bei positivem Screening-Befund die Diagnose bestätigt und ist abhängig von der Recall-Rate (Rate positiver Screening-Befunde) und der Prävalenz. Die Recall-Rate verbesserte sich im Lauf der Jahre von 0,90 % auf 0,37 %, wobei zwischen den einzelnen Krankheiten erhebliche Unterschiede bestehen (Tabelle 2, Grafik 2). Aktuell (Daten aus 2018) sind unter 100 000 Screening-Untersuchungen 370 positive Befunde zu erwarten, von denen sich 78 bestätigen (PPV = 21,1 %). Das bedeutet, dass sich bei jedem fünften Kind mit positivem Screening-Befund der Krankheitsverdacht bestätigt; bei hochpathologischem Befund ist dies zumeist der Fall (91,434 % bestätigt in der Konfirmationsdiagnostik). Die Sensitivität kann nicht berechnet werden, da die Anzahl der im Screening übersehenen Kinder nicht systematisch erfasst wird.
Grafik 2
Recall-Raten ausgewählter Zielkrankheiten im deutschen Neugeborenen-Screening
Bild vergrößernAlle Bilder
Tabelle 2
Rate der pathologischen Screening-Befunde (Recall-Rate) und positiver Vorhersagewert (PPV)
Bild vergrößernAlle Bilder
„Loss to follow-up“
Von 272 205 angeforderten Kontrolluntersuchungen, darunter 5 149 nach positivem Screening-Befund, wurden 54 408 (19,99 %) nicht durchgeführt („loss to follow-up“) . Von weiteren 727 Kindern der 7 565 Neugeborenen (9,61 %) mit hochgradigem Verdacht auf eine Zielkrankheit (Grafik 1) liegen keine Angaben über eine Konfirmationsdiagnostik vor, darunter ein Drittel mit Verdacht auf Hypothyreose. Bei 443 dieser Kinder waren die Befunde aus dem Screening auch in der Kontrollkarte eindeutig, sodass sie in die Berechnung der Prävalenz einbezogen werden konnten. In 284 Fällen (3,75 %) war dies nicht möglich.
Insgesamt ist die Abklärung von 11,40 % der 51 531 positiven Screening-Befunde nicht erfolgt oder unklar (Grafik 1). Mit 1,14–37,28 % fehlenden Informationen zur Konfirmationsdiagnostik bestehen unter den Laboren große Diskrepanzen.
Diskussion
Erstmalig werden hier der Screening-Prozess und die Ergebnisse des „Erweiterten Neugeborenen-Screenings“ für ganz Deutschland von 13 Geburtskohorten mit insgesamt 9, 2 Mio. Kindern im Längsschnitt dargestellt. Die Ergebnisse zeigen, dass das Neugeborenen-Screening auch in einer föderalen Struktur mit elf Laboren (eKasten 1) sehr erfolgreich umgesetzt werden kann, wenn die Verantwortlichkeiten und Abläufe klar geregelt sind. So kann davon ausgegangen werden, dass nahezu alle Neugeborenen gescreent werden, auch wenn nur in wenigen Regionen ein personenbezogener Abgleich zwischen geborenen und gescreenten Kindern erfolgt (3). Ebenso gelingt der frühzeitige Behandlungsbeginn bei der Hälfte der betroffenen Kinder (Median) innerhalb von sieben Tagen und bei 79,05 % innerhalb von zwei Wochen. Dies entspricht etwa den aus Norwegen berichteten Daten (Median = 6 Tage) und ist deutlich früher als der 2012 für Europa von Burgard et al. (11) publizierte Median von 14,9 Tagen und eine Abklärung von 75 % der positiven Screening-Ergebnisse innerhalb von 20 Tagen. Wie wichtig die frühe Diagnosestellung und Therapie sein können, zeigten Odenwald et al. für Kinder mit adrenogenitalem Syndrom (AGS). Begann die Behandlung mit drei Tagen, so zeigten 23,5 % der Kinder eine Elektrolytverschiebung, bei einem Therapiebeginn von zwölf oder mehr Tagen erlitten 50 % eine Salzverlustkrise (Elektrolytverschiebung: 94,4 %) (12). Auch bei anderen Erkrankungen kann ein entsprechend früher Therapiebeginn im Hinblick auf Krisen oder mögliche Langzeitfolgen entscheidend sein (13, 14, 15). Insgesamt ermöglicht das ENS den allermeisten betroffenen Kindern durch die frühe Therapie eine normale Entwicklung (13, 16, 17).
Deutlich wird der positive Effekt von klaren Regelungen bei Reihenuntersuchungen, wenn die nicht geregelten Komponenten betrachtet werden. Das sind zum einen fehlende Regelungen zum Tracking, zum anderen werden Erkrankte für viele Zielerkrankungen nicht systematisch erfasst. Letzteres ist unter strenger Beachtung des Datenschutzes entweder in Registern oder durch systematische Abfragen in den Behandlungszentren durchaus möglich, wie es für einige seltene Erkrankungen auch in Deutschland publiziert ist (18, 19, 20, 21) und international gefordert wird (22, 23, 24, 25, 26). Nur wenn die Daten aller betroffenen Kinder zusammengeführt werden, sind valide Aussagen zur Sensitivität des Screenings möglich. Für die Stoffwechselerkrankungen kann von einer hohen Sensitivität ausgegangen werden, da diese seltenen Erkrankungen in der Regel in wenigen Stoffwechselzentren behandelt werden. Hier wurden nur wenige falsch-negative Screening-Befunde bekannt. Bei den endokrinologischen Erkrankungen ist dies unklarer, da Kinder mit Hypothyreosen auch in den Praxen niedergelassener Ärzte behandelt werden. Grundsätzlich sollte bei klinischem Verdacht auf eine der Zielkrankheiten auch nach unauffälligem Screening-Befund eine spezifische Diagnostik erfolgen.
Für mehr als 55 000 Kinder, darunter 5 876 mit positivem Screening-Befund, ist nicht dokumentiert, ob der Befund jemals kontrolliert und abgeklärt wurde („loss to follow-up“). Ob die Eltern von dem für das Screening verantwortlichen Einsender nicht informiert beziehungsweise erreicht wurden oder ob sie das Neugeborene nicht zur zweiten Blutabnahme vorgestellt haben, ist nicht bekannt. Unklar ist auch, wie häufig der positive Befund nicht weiter abgeklärt wurde oder ob das behandelnde Zentrum oder der Kinderarzt das Ergebnis der Konfirmationsdiagnostik dem Screening-Labor nicht mitgeteilt hat. Um dieses Problem zu beheben, ist ein strukturiertes Erinnerungssystem notwendig, wie es zum Beispiel in Bayern seit 1999 mit einem Tracking-Zentrum etabliert ist (6, 7, 8, 9). In anderen Bundesländern wird das Tracking zum Teil engagiert von den Laboren durchgeführt, ist jedoch ohne Finanzierung abhängig von den möglichen lokalen Ressourcen. Ergebnisse der Konfirmationsdiagnostik zu kennen, ist für das Labor auch zur Qualitätssicherung und Optimierung der Analytik wichtig.
Die Rate an „loss to follow-up“ und der Aufwand für das Tracking nehmen mit jeder neu ins Screening-Panel aufgenommenen Zielkrankheit weiter zu. Hier wird dringender Handlungsbedarf gesehen. Durch eine Aufnahme des Trackings in die Kinder-Richtlinie und entsprechende Finanzierung könnte diese Aufgabe, neben unabhängigen Zentren, den Screening-Laboren übertragen werden.
Ein entscheidender Faktor für die hohe Effektivität des ENS ist auch die niedrige Rate an positiven Screening-Befunden (Recall), denn jeder falsch-positive Befund führt zu unnötiger Beunruhigung der Familien und Kosten im Gesundheitssystem. Mittlerweile sind die Gütekriterien des ENS mit einer Recall-Rate von 0,37 % (2018) und einem PPV von 21 % weit besser als in anderen Screening-Verfahren, die auch als effektiv zu bewerten sind (Mammografie-Screening: Recall-Rate 3–14 %, PPV 2–22 % [27]; Hör-Screening: Recall-Rate 5,3 %, PPV 6,2 % [28]). Eine weitere Verbesserung wäre durch den Einsatz zusätzlicher Analyseverfahren in einem zweiten Untersuchungsschritt aus derselben Blutprobe bei auffälligem Screening-Wert („second tier“) möglich, ohne erkrankte Kinder zu übersehen. Dies zeigt sich beim AGS-Screening eindrucksvoll (Grafik 2) (29, 30) und ist für weitere Krankheiten denkbar. Allerdings steigen damit die Kosten des Screenings. In einigen Ländern, wie zum Beispiel Norwegen oder Schweden, werden „second tier“-Analysen auch für metabolische Erkrankungen des Screening-Panels eingesetzt (31, 32), in Deutschland im Rahmen von Studien (33, 34).
Bei der hohen Anzahl von circa 9, 2 Mio. gescreenten Kindern können die Prävalenzen der seltenen angeborenen Erkrankungen für Deutschland valide berechnet werden, auch wenn einige Prävalenzen in den vorliegenden Daten auf Grund von „loss to follow-up“ und fehlender Rückmeldungen von im Screening nicht entdeckten Fällen unterschätzt werden könnten. Die Prävalenzen sind nicht zwingend aus anderen Populationen übertragbar und zeigen zum Teil deutliche Abweichungen von den zuvor auf Basis deutlich kleinerer Fallzahlen und oft aus anderen Ländern übernommenen und publizierten Werten (Tabelle 1) (16).
Datengrundlage
In dieser Arbeit werden die wichtigsten Ergebnisse der Screening-Reporte 2006–2018 dargestellt und interpretiert (5). Die von der DGNS erstellten Berichte entsprechen in vielen Punkten den Qualitätskriterien, die von Cornel et al. (24) sowie Ojodu et al. (35) für die Evaluation eines Screening-Programms vorgeschlagen beziehungsweise gefordert werden. Limitationen dieser Daten bestehen zum einen darin, dass keine analytischen Einzelergebnisse vorliegen und die Prozessdaten nur kumulativ bereitgestellt werden; zum anderen fehlen Rückmeldungen der behandelnden Ärzte über die Konfirmationsdiagnostik an die Labore, die für die Validation der Verdachtsfälle benötigt werden. Zu letzterem wären verpflichtende Regelungen unter Berücksichtigung der Vorgaben des Datenschutzes in der Kinder-Richtlinie sehr hilfreich.
Im Gegensatz zu den staatlich organisierten und finanzierten Berichten in den Niederlanden, in Großbritannien und Norwegen (32, 36, 37) wird der deutsche Report auf Eigeninitiative der Fachgesellschaft (DGNS) und der Labore erstellt und seit mehr als zehn Jahren als einziger Qualitätsbericht zum Neugeborenen-Screening in Deutschland publiziert (5). Um eine hohe Qualität des Neugeborenen-Screenings sicherzustellen und um Entwicklungen und Trends – auch in Bezug auf neue Zielkrankheiten – zeitnah zu erkennen, zu kommunizieren und das Screening weiter zu optimieren, sollten weitergehende Regelungen zur Qualitätssicherung und Evaluation in der Kinder-Richtlinie angestrebt werden.
Fazit
Das Neugeborenen-Screening wird flächendeckend in Deutschland mit großem Erfolg umgesetzt und ist ein eindrucksvolles Beispiel für eine wirksame Präventivmaßnahme in der Pädiatrie, die kontinuierlich optimiert wird. In seiner Gesamtheit ist das Screening ein komplexer Prozess, in den verschiedene Akteure aus unterschiedlichen Bereichen eingebunden sind. Eine dauerhafte Sicherung der hohen Qualität des Neugeborenen-Screenings ist nur garantiert, wenn alle Komponenten des Screenings einem kontinuierlichen Verbesserungsprozess unterliegen. Die Etablierung von Tracking-Strukturen, eines Registers und einer kontinuierlichen Qualitätssicherung sowie die Evaluation neuer oder geänderter Screening-Untersuchungen sind hierfür notwendig.
Danksagung
Unser besonderer Dank gilt Prof. Dr. med. Heiko Krude und Erwin Lankes (Charité Berlin) für die Unterstützung bei der Validierung der endokrinologischen Krankheiten sowie Prof. Dr. med. Esther Maier (Dr. von Haunersches Kinderspital LMU München) bei der Validierung von Stoffwechselkrankheiten.
Contributors
Screening-Labore Deutschland:Dr. med. Oliver Blankenstein, Neugeborenen-Screeninglabor der Charité, Universitätsmedizin Berlin; Prof. Dr. rer. nat. Uta Ceglarek, Screeninglabor Leipzig, Institut für Laboratoriumsmedizin, Klinische Chemie und Molekulare Diagnostik (ILM), Universitätsklinikum Leipzig; Dr. rer. nat. Marina Stopsack, Institut für Klinische Chemie und Laboratoriumsmedizin, Universitätsklinikum Carl Gustav Carus an der TU Dresden; PD Dr. med. Martin Lindner, Screening-Zentrum Hessen, Universitätsklinikum Frankfurt; Dr. rer. nat. Cornelia Müller, Neugeborenenscreeningzentrum Mecklenburg-Vorpommern, Universitätsmedizin Greifswald; Prof. Dr. med. René Santer, Screeninglabor Hamburg, Universitätskinderklinik Hamburg; Dr. med. Dr. rer. nat. Nils Janzen, Screening-Labor Hannover; Prof. Dr. med. Gwendolyn Gramer, Neugeborenenscreening Heidelberg, Universitätsklinikum Heidelberg; Dr. med. Katrin Borucki, Institut für Klinische Chemie und Pathobiochemie, Universitätsklinikum Magdeburg; PD Dr. med. Wulf Röschinger, Labor Becker & Kollegen, Neugeborenen-Screening, München; Dr. med. Dr. rer. nat. Hans-Wolfgang Schultis, Screening-Labor, SYNLAB Medizinisches Versorgungszentrum Weiden
Interessenkonflikt
Dr. Nennstiel erhielt Reisekostenerstattung und Vortragshonorare von der Firma Biogen.
Die übrigen Autoren erklären, dass kein Interessenkonflikt besteht.
Manuskriptdaten
eingereicht: 31. 10. 2019, revidierte Fassung angenommen: 15. 9. 2020
Anschrift für die Verfasser
Dr. med. Uta Nennstiel, MPHBayerisches Landesamt für Gesundheit und LebensmittelsicherheitVeterinärstraße 2, 85764 OberschleißheimUta.Nennstiel@lgl.bayern.de
Zitierweise
Lüders A, Blankenstein O, Brockow I, Ensenauer R, Lindner M, Schulze A, Nennstiel U, on behalf of the screening laboratories in Germany: Neonatal screening for congenital metabolic and endocrine disorders—results from Germany for the years 2006–2018. Dtsch Arztebl Int 2021; 118: 101–8.
DOI: 10.3238/arztebl.m2021.0009
►Die englische Version des Artikels ist online abrufbar unter: www.aerzteblatt-international.de
Zusatzmaterial
eGrafiken, eKästen:www.aerzteblatt.de/m2021.0009 oder über QR-Code
1.
Richtlinie des Gemeinsamen Bundesausschusses über die Früherkennung von Krankheiten bei Kindern (Kinder-Richtlinie), 2020; §§ 13–28. www.g-ba.de/downloads/62-492-2156/Kinder-RL_2020-05-14_iK-2020-03-25.pdf (last accessed on 15 July 2020).
2.
Richtlinie des Gemeinsamen Bundesausschusses über die Früherkennung von Krankheiten bei Kindern (Kinder-Richtlinie), 2020; §§ 29–42. www.g-ba.de/downloads/62-492-2156/Kinder-RL_2020-05-14_iK-2020-03-25.pdf (last accessed on 15 July 2020).
3.
Nennstiel-Ratzel U, Lüders A, Blankenstein O: Neugeborenenscreening: ein Paradebeispiel für effektive Sekundärprävention. Bundesgesundheitsblatt Gesundheitsforschung Gesundheitsschutz 2015; 58: 139–45 CrossRef MEDLINE
4.
Gesetz über genetische Untersuchungen am Menschen (Gendiagnostikgesetz- GenDG), Ausfertigungsdatum 31.07.2009. www.gesetze-im-internet.de/gendg/BJNR252900009.html (last accessed on 15 July 2020).
5.
Nennstiel U, Lüders A, Blankenstein O, et al.: DGNS Screening Reports. www.screening-dgns.de/reports.php (last accessed on 15 July 2020).
6.
Nennstiel-Ratzel U, Liebl B, Zapf A: Modellprojekt zur Neuordnung des Neugeborenen-Screenings in Bayern. Gesundheitswesen 2003; 65: S31–5 CrossRef MEDLINE
7.
Liebl B, Nennstiel-Ratzel U, von Kries R, et al.: Expanded newborn screening in Bavaria: tracking to achieve requested repeat testing. Prev Med 2002; 34: 132–7 CrossRef MEDLINE
8.
Liebl B, Nennstiel-Ratzel U, von Kries R, et al.: Very high compliance in an expanded MS-MS-based newborn screening program despite written parental consent. Prev Med 2002; 34: 127–31 CrossRef MEDLINE
9.
Liebl B, von Kries R, Nennstiel-Ratzel U, et al.: Ethisch-rechtliche Aspekte des Neugeborenenscreenings. Monatsschr Kinderheilkd 2001; 149: 1326–35 CrossRef
10.
Statistisches Bundesamt Deutschland – GENESIS-Online: Ergebnis 12612–0001 (destatis.de) (last accessed on 15 July 2020).
11.
Burgard P, Rupp K, Lindner M, et al.: Newborn screening programmes in Europe; arguments and efforts regarding harmonization. Part 2. From screening laboratory results to treatment, follow-up and quality assurance. J Inherit Metab Dis 2012; 35: 613–25 CrossRef MEDLINE
12.
Odenwald B, Dörr HG, Bonfig W, et al.: Classic congenital adrenal hyperplasia due to 21-hydroxylase-deficiency: 13 years of neonatal screening and follow-up in Bavaria. Klin Padiatr 2015; 227: 278–83 CrossRef MEDLINE
13.
Mütze U, Garbade S, Gramer G, et al.: Long-term outcomes of individuals with metabolic diseases identified through newborn screening. Pediatrics 2020; DOI: 10.1542/peds.2020–0444 (epub ahead of print) CrossRef MEDLINE
14.
Schweitzer-Krantz S: Early diagnosis of inherited metabolic disorders towards improving outcome: the controversial issue of galactosaemia. Eur J Pediatr 2003; 162: S50–3 CrossRef MEDLINE
15.
Leger J, Olivieri A, Donaldson M, et al.: European Society for Paediatric Endocrinology consensus guidelines on screening, diagnosis, and management of congenital hypothyroidism. Horm Res Paediatr 2014; 81: 80–103 CrossRef MEDLINE
16.
Schlune A, Riederer A, Mayatepek E, Ensenauer R: Aspects of newborn screening in isovalerica acidemia. Int J Neonatal Screen 2018; DOI: 10.3390/ijns4010007 CrossRef MEDLINE PubMed Central
17.
Nennstiel-Ratzel U, Arenz S, Maier EM, et al.: Reduced incidence of severe metabolic crisis or death in children with medium chain acyl-CoA dehydrogenase deficiency homozygous for c.985A>Gidentified by neonatal screening. Mol Genet Metab 2005; 85: 157–9 CrossRef MEDLINE
18.
El-Helou SM, Biegner AK, Bode S, et al.: The German National Registry of Primary Immunodeficiencies (2012–2017). Front Immunol 2019; 10; DOI: 10.3389/fimmu.2019.01272 CrossRef MEDLINE PubMed Central
19.
Nährlich L (ed.), Burkhard J, Wosniok J: Deutsches Mukoviszidose-Register Berichtsband 2018. www.muko.info/fileadmin/user_upload/angebote/qualitaetsmanagement/register/berichtsbaende/berichtsband_2018.pdf (last accessed on 15 July 2020).
20.
Ebrahimi-Fakhari D, Zemlin M, Sauer H, Poryo M, Graf N, Meyer S: Erhebungseinheit für seltene pädiatrische Erkrankungen in Deutschland (ESPED) – 25 Jahre pädiatrische Epidemiologie: Eine Bestandsaufnahme. Klin Padiatr 2018; 230: 215–24 CrossRef MEDLINE
21.
Shai S, Perez-Becker R, Andres O, et al.: Incidence of SCID in Germany from 2014 to 2015. An ESPED survey on behalf of the API Erhebungseinheit für seltene padiatrische Erkrankungen in Deutschland (German Paediatric Surveillance Unit). J Clin Immunol 2020; 40: 708–17 CrossRef MEDLINE
22.
Hoffmann GF, Lindner M, Loeber JG: 50 years of newborn screening. J Inherit Metab Dis 2014; 37: 163–4 CrossRef MEDLINE
23.
Starkweather A, Coleman B, Barcelona de Mendoza V, et al.: Policy brief: improve coverage of newborn genetic screening to include the Recommended Uniform Screening Panel and newborn screening registry. Nurs Outlook 2017; 65: 480–4 CrossRef MEDLINE PubMed Central
24.
Cornel MC, Rigter T, Weinreich SS, et al.: A framework to start the debate on neonatal screening policies in the EU: an Expert Opinion Document. Eur J Hum Genet 2014; 22: 12–7 CrossRef MEDLINE PubMed Central
25.
Kanungo S, Patel DR, Neelakantan M, Ryali B: Newborn screening and changing face of inborn errors of metabolism in the United States. Ann Transl Med 2018; 6: 468 CrossRefMEDLINE PubMed Central
26.
Lund AM, Hougaard DM, Simonsen H, et al.: Biochemical screening of 504,049 newborns in Denmark, the Faroe Islands and Greenland – experience and development of a routine program for expanded newborn screening. Mol Genet Metab 2012; 107: 281–93 CrossRef MEDLINE
27.
Mandrik O, Zielonke N, Meheus F, et al.: Systematic reviews as a ‚lens of evidence‘: determinants of benefits and harms of breast cancer screening. Int J Cancer 2019; 145: 994–1006 CrossRef MEDLINEPubMed Central
28.
Nennstiel U, Brockow I, Söhl K, et al.: Endbericht zur Evaluation des Neugeborenen-Hörscreenings 2011/2012, Stand 15.01.2017. www.g-ba.de/downloads/17-98-4329/2017-05-18_Kinder-RL_Annahme_Endbericht_NHS-Bericht.pdf (last accessed on 15 July 2020).
29.
Janzen N, Sander S, Terhardt M, Peter M, Sander J: Fast and direct quantification of adrenal steroids by tandem mass spectrometry in serum and dried blood spots. J Chromatogr B Analyt Technol Biomed Life Sci 2008; 861: 117–22 CrossRef MEDLINE
30.
Janzen N, Peter M, Sander S, et al.: Newborn screening for congenital adrenal hyperplasia: additional steroid profile using liquid chromatography-tandem mass spectrometry. J Clin Endocrinol Metab 2007; 92: 2581–9 CrossRef MEDLINE
31.
Sörensen L, von Döbeln U, Ahlmann H, et al.: Expanded screening of one million Swedish babies with R4S and CLIR for post-analytical evaluation of data. Int J Neonatal Screen 2020; 6: 42 CrossRef PubMed Central
32.
Tangeraas T, Sæves I, Klingenberg C, et al.: Performance of expanded newborn screening in Norway supported by post-analytical bioinformatics tools and rapid second-tier DNA analyses. Int J Neonatal Screen 2020; 6: 51 CrossRef MEDLINE PubMed Central
33.
Röschinger W, Sonnenschein S, Schumann E, Nennstiel-Ratzel U, Roscher AA, Olgemöller B: Neue Zielerkrankungen im Neugeborenenscreening Empfehlungen aus einem Pilotprojekt. Monatsschr Kinderheilkd 2015; 2: 142–9 CrossRef
34.
Gramer G, Hauk F, Lobitz S, Sommerburg O, Speckmann C, Hoffmann GF: Neugeborenenscreening 2020. Monatsschr Kinderheilkd 2017; 165: 216–25 CrossRef
35.
Ojodu J, Singh S, Kellar-Guenther Y, et al.: NewSTEPs: the establishment of a national newborn screening technical assistance resource center. Int J Neonatal Screen 2018; 4: 1 CrossRef MEDLINEPubMed Central
36.
van der Ploeg K, Wins S, Verkerk PH. The newborn blood spot screening in the Netherlands monitor 2018. www.rivm.nl/sites/default/files/2020-01/HielprikMon2018-Engelstalig.pdf (last accessed on 15 July 2020).
37.
Begum F: Newborn Blood Spot Screening Programme in the UK. Data collection and performance analysis report 2016 to 2017. Published May 2018. https://assets.publishing.service.gov.uk/government/uploads/system/uploads/attachment_data/file/709367/Newborn_blood_spot_screening_data_collection_and_performance_analysis_report_2016_to_2017.pdf (last accessed on 15 July 2020).
38.
Lobitz S, Frömmel C, Brose A, Klein J, Blankenstein O: Incidence of sickle cell disease in an unselected cohort of neonates born in Berlin, Germany. Eur J Hum Genet 2014; 22: 1051–3 CrossRef MEDLINE PubMed Central
39.
Frömmel C, Brose A, Klein J, Blankenstein O, Lobitz S: Newborn screening for sickle cell disease: technical and legal aspects of a German pilot study with 38,220 participants. Biomed Res Int 2014; 2014: 695828 CrossRef MEDLINE PubMed Central
40.
Vill K, Kölbel H, Schwartz O, et al.: One year of newborn screening for SMA – results of a German pilot project. J Neuromuscul Dis 2019; 6: 503–1 CrossRef MEDLINE PubMed Central