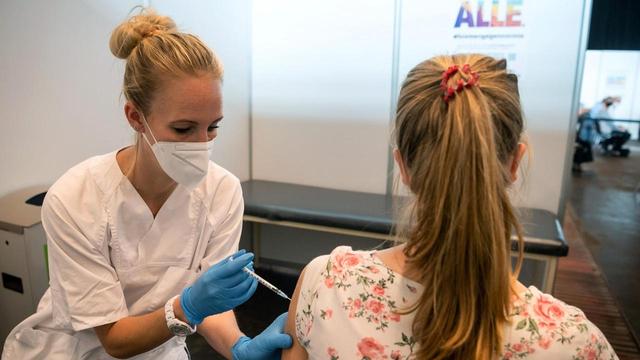
Dr. Claudia Weiß: "Percibimos claramente un espíritu de optimismo". - dr Arpad von Moers: "Y, por supuesto, todos lo quieren". – Mona Hoffmann: "Realmente le está yendo mejor ahora que nunca. Por supuesto, dada su edad, todavía es un poco diferente a los niños sanos. Pero es perfecta tal como es". –Emma Hoffmann: "Emma Hoffmann".
Emma tiene dos años, charla y juega con sus padres, Jan y Mona Hoffmann. Una escena cotidiana, pero cualquier cosa menos evidente. Emma está atada a una silla especial con reposacabezas y una mesa. No puede mantener la cabeza erguida por mucho tiempo y apenas puede levantar los brazos. "Bueno, en realidad nos dimos cuenta, alrededor de cinco o seis meses, que sus movimientos eran cada vez menos. Entonces podía darse la vuelta. Eso prácticamente se detuvo de la noche a la mañana", dice Mona Hoffmann.
Atrofia muscular espinal. Una rara enfermedad hereditaria. El gen SMN1 es defectuoso. Orquesta la implementación de la información genética en las células nerviosas de la médula espinal. Sin SMN1, los nervios mueren, los músculos ya no se controlan y se atrofian. Los niños con atrofia muscular espinal tipo 1 nunca aprenden a sentarse sin ayuda.
La mayoría de ellos ni siquiera viven hasta los dos años porque los músculos de sus pulmones están fallando. Gracias a la ayuda de los ventiladores, la esperanza de vida ahora es mayor. "Bueno, me afectó mentalmente. También caí en una depresión y realmente no pude sobrellevarlo", informa Mona Hoffmann.
Nuevas aproximaciones terapéuticas en la atrofia muscular espinal
El futuro: negro. Pero el presente es Emma, su niña feliz. "Más leche, más agua, come tú mismo", dice Emma. El padre Jan Hoffmann dice: "Sobre todo, ella sabe lo que quiere". Emma: "¡Come leche, come cuchara, derramada! ¡Ayuda a mamá!"
Ningún gen se convierte uno a uno en las células humanas. En primer lugar, se realizan y optimizan copias de trabajo de los genes de diversas maneras. Solo entonces emerge la proteína terminada.
Hasta la fecha, no existe una terapia génica real para la atrofia muscular espinal de Emma. Pero a nivel de copia de trabajo, los investigadores han encontrado una palanca. "Ese es un logro sensacional. Ahora que las causas de las enfermedades musculares se han aclarado durante décadas, y ahora, por primera vez, existen enfoques terapéuticos que realmente parecen provocar un cambio en la atención clínica de los pacientes".
El neuropediatra Janbernd Kirschner del Hospital Universitario de Freiburg está de acuerdo con su colega Arpad von Moers del DRK Kliniken Westend de Berlín: todo el campo de las enfermedades nerviosas y musculares hereditarias ha comenzado a moverse: "Ahora aquí, en esta área especial, en Significant ya se han logrado avances en la atrofia muscular espinal y esto ciertamente se refleja en otras áreas".
También se aprobaron nuevos medicamentos para la distrofia muscular de Duchenne y se están realizando estudios para la enfermedad de Huntington. Las terapias siguen enfoques muy diferentes y, sin embargo, tienen una cosa en común: ayudan al paciente a sobrellevar la situación a pesar de los genes enfermos. Los preparativos tomaron muchos años, hubo contratiempos, los éxitos de los experimentos con animales no pudieron repetirse en pacientes humanos. Pero en los últimos dos años la marea parece estar cambiando.
Los pacientes y sus familias ya sueñan con una cura, aunque todavía no se dispone de experiencia a largo plazo, explica von Moers: "Todo lleva varios años para pasar por todos los procesos de estudio. Por eso, siempre hay que tener esperanza y los hechos uno al lado del otro".
Un nuevo fármaco da esperanza
Nusinersen. Disponible en Alemania desde enero de 2017 para el tratamiento de niños con atrofia muscular espinal. Pertenece a las drogas antisentido. Las secuencias genéticas cortas coinciden con las copias funcionales del gen SMN2, un gen SMN1 interrumpido que es irrelevante en individuos sanos. Nusinersen puede hacer que la copia de trabajo de SMN2 vuelva a funcionar. No es una solución perfecta, pero se produce suficiente proteína SMN para alimentar los nervios y mantener la fuerza muscular.
"Se observó que los pacientes que fueron tratados con este medicamento desarrollaron habilidades motoras significativamente mejores que los pacientes en el grupo de placebo", informa von Moers, quien solo recibió un fármaco ficticio. Este trato desigual ya no era éticamente justificable. El estudio se detuvo en 2016 y se solicitó la aprobación. Nusinersen ahora está disponible en los EE. UU. En Europa, los procedimientos aún están en curso, pero existe un programa de dificultades para los niños particularmente afectados.
¿Droga ingeniosa?
Ryan Collin está acostado en una cama en la unidad de cuidados intensivos neonatales del DRK Kliniken Westend. Tiene ocho meses, muchos de los cuales los pasó en el hospital. Ryan también sufre de atrofia muscular espinal. Sus músculos pulmonares están afectados. Se ventila a través de un corte en la tráquea, obtiene su leche a través de un tubo estomacal. "Siempre está de buen humor, pase lo que pase, siempre nos sonríe", dice su madre, Jeannette Wonsik. "Y así es como sabemos que estamos tomando las decisiones correctas para él. Nos da esperanza, el hombrecito".
Ryan está en el programa de emergencia, recibe Nusinersen. Para que el fármaco llegue realmente a los nervios de la médula espinal, debe apuntar allí. Sin embargo, Jeannette Wonsik no dudó: "Así que al principio dijimos, ¿qué nos queda por perder? Lo intentaremos".
La inyección en la médula espinal es una rutina para la doctora de Ryan, Manuela Theophil. Ella asegura un ambiente estéril, monitorea la respiración y la circulación y le da a Ryan un sedante para que no se mueva: "El procedimiento real es que perforas el canal espinal debajo de la médula espinal, para que la médula espinal no se vea afectada para que no se mueva". lesionado Este es el procedimiento.
Los efectos secundarios aún no han ocurrido con Ryan tampoco. “Está bien, ahora abre las manos, las mueve bastante bien, juega un poco con el móvil”, cuenta su madre. "Trate de girar la cabeza hacia adelante y hacia atrás y también mueva las piernas hacia arriba. Y me parece increíble que una droga tan simple pueda generar tanto movimiento. Ahora solo queda la esperanza de que la respiración también consiga algo".
Theophil informa: "Los padres que vienen por la segunda, tercera o múltiples dosis, te saludan con una sonrisa. Y si la droga cumple lo que promete, es una droga ingeniosa. A ver qué pasa con el tiempo".
Medicamentos solo disponibles para casos difíciles
El programa de dificultades solo cubre las formas graves de atrofia muscular espinal tipo 1. Existen variantes más leves, en las que los niños también pierden fuerza gradualmente, solo que más tarde y de manera más gradual. Nusinersen probablemente también te ayudará, pero estos niños todavía no pueden conseguirlo en Alemania.
"Es muy difícil de soportar para los padres", dice Arpad von Moers. "Especialmente en combinación con la impresión de que cuanto antes, mejor será el éxito del tratamiento. Algunos están muy desesperados, algunos también han amenazado con emprender acciones legales porque a su hijo se le niega el tratamiento. Existe, por así decirlo, todo el espectro de formas más agresivas". pero sobre todo, reacciones desesperadas".
"Puedes saber si no puedes seguir el ritmo"
Sebastian Fedder sufre distrofia muscular de Duchenne (Deutschlandradio/Volkart Wildermuth)
Hockey en silla de ruedas. En el campo, los jugadores corren a diez kilómetros por hora, giran en el lugar a la velocidad del rayo, bloquean el camino del oponente. Para Sebastian Fedder, entrenar en el Rocky Rolling Wheels en Hohenschönhausen es lo más destacado de la semana: "Y por supuesto que puedes competir en absoluto. Solía hacer otras cosas cuando estaba un poco más en forma. Pero un deporte como ese, que realmente se adapta un poco a ti, es algo especial. Y siempre me ha gustado el hockey y hay bastante, así que fue muy divertido y realmente fascinante".
Sebastian Fedder está atascado en su silla de ruedas. A la derecha todavía tiene suficiente fuerza para sostener el bate, la mano izquierda controla a través de un pequeño joystick. Aún.
Distrofia muscular de Duchenne. Una forma de desgaste muscular hereditario. Conoce a uno de cada 3500 niños. Causa: una variedad de defectos diferentes en el gen de la distrofina. La distrofina es importante para la estabilidad y la transmisión de energía en las células musculares. Las niñas tienen dos copias del gen y, por lo tanto, rara vez se enferman. Los niños con una mutación de distrofina primero se vuelven torpes y luego no pueden caminar. Gradualmente, más y más grupos musculares fallan. En la edad adulta temprana, los músculos respiratorios y cardíacos también fallan.
"Tú mismo lo notas cuando no puedes seguir el ritmo de otras personas de la misma edad", dice Fedder. "Por supuesto que siempre está en la habitación. Y por supuesto también significa que a veces estás roto. Pero bueno, a esa edad otras personas pueden tener otros problemas. No siempre estás de buen humor".
Sebastian Fedder tiene 27 años. No todos los pacientes viven tanto tiempo. El factor decisivo es dónde y de qué manera se modifica el gen de la distrofina. Hay muchas posibilidades, después de todo, es el gen humano más grande conocido. Sebastian Fedder tiene una mutación puntual, solo una de las 2,5 millones de letras genéticas está equivocada.
"Este cambio significa que una señal de alto aparece demasiado pronto y la producción de la proteína se detiene prematuramente", explica el Prof. Janbernd Kirschner, médico jefe de la Clínica de Neuropediatría y Enfermedades Musculares del Hospital Universitario de Freiburg. Y así se desarrollaron medicamentos especiales que cubren esta señal de alto, se podría decir en sentido figurado, y conducen al hecho de que la proteína se puede producir en su totalidad".
La compañía de seguros de salud aprueba un intento de terapia individual
Atalura. Una pequeña molécula que ayuda a la célula a ignorar la señal de parada incorrecta en el gen de la distrofia. Esto no sucede con todos los procesos de lectura, pero sí con una parte significativa. En un estudio, los participantes de la prueba inicialmente no mostraron ninguna mejora. Sin embargo, a largo plazo, la droga parece tener un efecto positivo. Ataluren ha sido aprobado provisionalmente en Europa desde 2014 hasta que un estudio más amplio arroje resultados claros. Las autoridades estadounidenses aún dudan.
"Luego leímos al respecto y luego preguntamos al respecto y luego simplemente lo solicitamos con la compañía de seguros de salud como un tratamiento individual o un intento de terapia", dice Fedder. "Y luego, tengo que decirme a mí mismo, honestamente no lo esperaba, luego lo aprobaron".
Jan Fedder estaba electrizado. Ataluren solo está destinado a pacientes mayores de cinco años que todavía pueden caminar. Sebastian Fedder, en cambio, ya está en silla de ruedas. Pero la neuropediatra Claudia Weiß de la Charité de Berlín se compromete con él: “En el caso de este paciente, también le escribí a la compañía de seguros de salud que, en base al mecanismo de acción y datos iniciales que aún no se han publicado, hace tiene sentido tratar a estos pacientes también para mantener la fuerza del brazo y la función pulmonar durante el mayor tiempo posible". Incluso en el caso de un niño de tres años, en realidad demasiado pequeño para el tratamiento con Ataluren, Claudia Weiß pudo convencer a la compañía de seguros. La burocracia es alta.
"Tienes que decir muy claramente que no volverás a ponerte en forma con esto. Pero se debe evitar el progreso", explica Fedder. "Y tengo la sensación de que hará algo por mí. Y luego sería un poco más activo en el club deportivo y entrenaría un poco allí. Y estoy deseando que llegue".
Estudios con un gran número de pacientes imposibles
No hay pacientes para estudios significativos: las enfermedades genéticas son demasiado raras (dpa/picture-alliance/Waltraud Grubitzsch)
En el caso de un solo paciente, los efectos difícilmente pueden probarse objetivamente. Pero Sebastian Fedder sin querer hizo un pequeño experimento. Una vez se quedó inesperadamente tarde en un viaje y, como resultado, tuvo que saltarse una dosis de ataluren. "Y tengo que decir que al menos tuve la sensación de que todo era un poco más difícil y que no funcionaba tan bien, lo cual todavía puedo hacer yo mismo".
Cuando se trata de un nuevo medicamento para la diabetes, los estudios se realizan con cientos, a veces miles, de pacientes. Esto simplemente no es posible con las enfermedades hereditarias raras. A veces, solo unas pocas docenas de pacientes reciben el nuevo medicamento aquí. Claudia Weiß: "Ese es un problema muy grande. Eso no es suficiente para cubrir el espectro de efectos secundarios. Eso no es suficiente para poder realmente decir algo sobre la efectividad en una gran cantidad de pacientes".
La distrofia muscular de Duchenne ha demostrado recientemente lo difícil que es evaluar la situación de manera realista. Un fármaco que había convencido en experimentos con animales, incluso con los primeros pacientes parecía tener efecto. Al final, sin embargo, no se pudo detectar ningún efecto. Von Moers: "Todavía no hay un camino dorado, hay que mirarlo una y otra vez: ¿Qué riesgo estamos tomando, qué riesgo están tomando las familias? Y ciertamente siempre habrá situaciones en el área de enfermedades raras donde solo tienes que tomar una decisión. Está bien, lo estamos haciendo ahora sin tener una situación de datos realmente segura".
Nuevos conceptos listos para usar en pacientes
Las terapias génicas clásicas hasta ahora han logrado poco en el área de las enfermedades musculares hereditarias. Ahora existen enfoques más flexibles: fármacos antisentido y otros agentes para rescatar copias de trabajo genéticas defectuosas. Informes recientes de éxito muestran que los conceptos están listos para su uso en pacientes.
Sin embargo, persiste un problema fundamental con la distrofia muscular de Duchenne: el ataluren y otro fármaco aprobado en los EE. UU. pueden ayudar a alrededor de una cuarta parte de los pacientes. El resto tiene otras mutaciones en el gen de la distrofina, algunas de las cuales solo aparecen en un puñado de personas. Es prácticamente imposible desarrollar medicamentos clásicos para grupos tan pequeños.
Para ellos, el nuevo rayo de esperanza es: CRISPR Cas. La abreviatura esconde una herramienta que los investigadores copiaron de las bacterias. Consta de dos partes: tijeras para el material genético y una molécula corta que le dice a las tijeras por dónde empezar. Los ingenieros genéticos ahora han desarrollado CRISPR en un bisturí de alta precisión para operaciones en material genético.
Geneticista Cohn: lágrimas cuando la terapia tiene éxito
"Un día hubo un artículo en una revista inglesa, el Daily Telegraph, que hablaba de lo revolucionario que es este cambio, esta tecnología. Y luego, al día siguiente, tengo más de 30 correos electrónicos de padres de mis pacientes. Y eso es cuando decidí transformar por completo la investigación en mi laboratorio". El genetista Roland Cohn se especializó en CRISPR.
En el "Hospital for Sick Children" en Toronto, Canadá, pudo usar el nuevo método para corregir varios defectos genéticos en células de pacientes con Duchenne, incluido un tipo de tartamudeo en el gen de la distrofina que dificulta la información genética. para leer: una Duplicación, o duplicación, como dicen los genetistas, "La primera vez que vi que eliminamos la duplicación de uno de nuestros pacientes, en realidad el hijo de muy buenos amigos míos, y obtuvimos la proteína distrofina completa, es Fue un momento muy emotivo para mí. Lloré cuando vi la foto".
Precisamente porque los grupos de pacientes son tan pequeños, existe un vínculo mutuo muy estrecho con los investigadores. Esto motiva, pero también pone en peligro la objetividad. "Tenemos una reunión en nuestro laboratorio cada pocos meses en la que hablamos sobre las complicaciones éticas de nuestra investigación y también nos aseguramos, por ejemplo, de que ya no nombramos las células de los pacientes con las que trabajamos, sino solo números, para tomar un poco de lo personal fuera de la ciencia y también para reducir un poco la presión sobre los científicos que trabajan en mi laboratorio y sobre mí mismo".
¿Pacientes como conejillos de Indias?
CRISPR corta de forma fiable en la placa de Petri. Actualmente se están realizando experimentos con ratones en los que se han simulado mutaciones individuales de Duchenne. Los animales se enferman como los humanos. "Y ahora mismo estamos en el proceso de tratar a estos ratones con las construcciones CRISPR. Así que puedo decirles que todos estos son resultados preliminares, aún no hemos terminado, pero todo parece muy prometedor".
La aplicación humana aún está a años de distancia. Sebastian Fedder no tiene grandes esperanzas de que CRISPR lo beneficie. "Así que siempre es la pregunta: ¿cuándo entras allí? Si entras relativamente temprano, no quiero usar la palabra conejillo de indias ahora, pero al final es en parte así".
Especialmente cuando se trata de mutaciones de Duchenne muy raras, se tendrían que desarrollar conceptos de estudio completamente nuevos para posibles terapias CRISPR. Sobre todo porque es dudoso que las funciones que ya se han perdido se puedan recuperar de esta manera. Quizás en algún momento será posible estabilizar al menos las habilidades particularmente importantes en pacientes mayores como Sebastian Fedder. Por ejemplo, la movilidad de la mano para controlar la silla de ruedas.
Roland Cohn: "Conocí a un grupo de pacientes mayores de Dychenne en noviembre, todos tenían más de 20 años, y fue una experiencia increíble para mí cuando me dijeron: Mientras pueda mover la mano o el brazo, ese sería suficiente para mí. Por supuesto, todos quieren levantarse y caminar de nuevo. Pero creo que diferentes pacientes a diferentes edades tienen diferentes deseos, hablando de manera realista ahora".
Fedder responde: "Es importante para mí y sería feliz si realmente sale un medicamento en el que puedes decir: el progreso se detiene por completo o tal vez incluso las funciones regresan. Pero si no es así, no puedes cambiarlo y entonces todavía prefiero concentrarme en las cosas que todavía puedo hacer y luego no volverme loco".
"Incluso si es solo mi imaginación, ¡es increíble!"
"Finalmente comenzó una semana más tarde, después de que le pincharon, empezamos a notar un cambio. Se volvió un poco más activa con los brazos. Incluso si es solo mi imaginación, ¡es increíble!", informa Mona Hoffmann, la directora de Emma. madre. "¿A dónde fue? Ahí está" ¿A dónde fue? Pelota, oh, caída. ¿A dónde fue él? Gracias. Gracias, eso también".
"Estas son situaciones que no serían posibles sin medicamentos, que solo tenemos la fuerza para tirar la masa. Incluso si no está lejos, hay un progreso claro", dice feliz el padre Jan Hoffman.
"No podemos decir en este momento si esto conducirá a un desarrollo normal o casi normal en los niños", explica la neuropediatra Claudia Weiß. "No es muy probable, para ser honesto. Pero al menos esperamos que el curso de la enfermedad sea mucho más leve".
¿Exámenes de detección de atrofia muscular en recién nacidos?
Los recién nacidos ya están revisados en el hospital: aquí hay una prueba de audición (imagen central de dpa)
Claudia Weiß espera que, gracias a Nusinersen, más niños como Emma aprendan a sentarse de forma independiente, tal vez incluso a ponerse de pie, a pesar de su atrofia muscular espinal. Los músculos respiratorios podrían volverse más fuertes y, por lo tanto, una vida más larga. Todo lo que es ahora mismo: esperanza. Pero la esperanza inspira a padres y médicos. Nadie sabe si Nusinersen puede mantener a raya la enfermedad a largo plazo. Pero los estudios han demostrado una cosa, enfatiza Arpad von Moers:
"Cuanto antes, mejor. Eso significa que es probable que los pacientes que comienzan el tratamiento muy temprano se beneficien más que los que comienzan más tarde. Y hay un grupo tan pequeño de pacientes que han sido tratados desde el nacimiento y este grupo se está desarrollando sorprendentemente bien en comparación con los niños que conocemos con atrofia muscular espinal".
Se sabía que estos niños estaban en riesgo porque sus hermanos mayores ya tenían la enfermedad. La mayoría de las veces, sin embargo, ocurre inesperadamente. Se pierde mucho tiempo antes de que se noten los síntomas. "Eso significaría, en perspectiva, que habría que considerar incluir la atrofia muscular espinal en una especie de evaluación de recién nacidos", señala Weiss.
"Es un requisito previo importante que se trate de una enfermedad en la que se puede influir decisivamente con un tratamiento temprano", dice von Moers. "Y eso en realidad cumple con el criterio más importante para poder implementar este aspecto, cuanto antes, mejor será el éxito".
Evaluación de recién nacidos. Al tercer día de vida se extrae una gota de sangre para buscar indicios de 13 enfermedades tratables: fenilcetonuria, hipotiroidismo y desde 2016 también fibrosis quística.
$125,000 por una inyección
Si se confirma lo que Nusinersen promete hoy, entonces Claudia Weiß y Arpad von Moers pueden imaginar que la atrofia muscular espinal será la número 14 aquí. Pero entonces los niños tendrían que recibir el fármaco antisentido durante muchos años. Y eso será caro. El fabricante Biogen cobra $125.000 por una inyección en EE.UU. En el primer año, eso suma tres cuartos de millón por niño, y la dosis de mantenimiento debería costar más tarde la mitad. El neuropediatra Janbernd Kirschner: "Por supuesto, el número de pacientes que se tratan es relativamente pequeño y, sin embargo, los costos de desarrollo son inmensamente altos. Por lo tanto, es inevitable que los precios por paciente también sean bastante altos".
En última instancia, solo las empresas saben cómo se relacionan realmente los costes y los beneficios. “Hasta ahora no creo que eso sea realmente un problema para el sistema de salud, sobre todo si lo pones en relación con otros costos que surgen en el sistema de salud”, dice Kirchner. "Pero, por supuesto, si tales medicamentos se desarrollan para cada vez más enfermedades raras, los costos generales también podrían aumentar aquí".
La "más curable de las enfermedades cerebrales incurables"
Enfermedad de Huntington. Con esta enfermedad hereditaria, los pacientes primero se vuelven torpes a los 30 o 40 años, luego sus extremidades comienzan a contraerse involuntariamente hasta que quedan atrapados en una postura, a veces durante horas. Los síntomas se vuelven cada vez más severos y los afectados mueren dentro de diez a 20 años. La enfermedad se hereda de forma dominante. Esto significa que cada paciente podría ver de un padre qué esperar.
"Soy un optimista nato. Pero hay buenas razones para ser optimista acerca de la EH". Edward Wild, neurólogo del University College London, una vez describió la enfermedad de Huntington en un artículo como "la más curable de las enfermedades cerebrales incurables". A diferencia del Alzheimer o el Parkinson, la causa del Huntington se conoce desde hace más de 20 años: un cambio en un gen del cromosoma 4, que convierte la proteína derivada de éste en un veneno para las células nerviosas.
Ionis HTTPRx. Este fármaco antisentido se une a la copia de trabajo del gen de la EH y hace que las células lo descompongan. Se produce mucha menos proteína tóxica y los nervios sobreviven. Al igual que Nusinersen, HTTRx debe inyectarse en el líquido cefalorraquídeo. Los experimentos con animales muestran que la droga puede detener la progresión de los síntomas y, en algunos casos, incluso revertirlos.
"Les dimos a los pacientes las primeras inyecciones en septiembre de 2015", informa Wild. "Durante estos 18 meses, las dosis se han aumentado varias veces sin ningún efecto secundario. Estamos administrando un fármaco que afecta la actividad de los genes en el cerebro. Que no haya habido problemas significativos aquí es realmente un importante paso adelante".
El estudio durará hasta finales de 2017. Solo entonces quedará claro si HTTRx también funciona en el cerebro humano y si esto tiene un impacto en los trastornos del movimiento.
Creando nuevas perspectivas
Mona Hoffmann: "Definitivamente es más fuerte, un poco más activa con la función de su brazo. Ahora puede sostener una cuchara un poco más, lo que simplemente no podía hacer antes. Revolver la taza también funciona bastante bien y golpear algo con el artículo ayuda a mamá". Su esposo Jan dice: "La esperanza siempre es bastante difícil. ¿Qué esperas? Que la calidad de vida sea mejor que sin medicamentos. Que su esperanza de vida aumente significativamente y que cuando crezca en algún momento también participe". correctamente en la vida puede".
Jan y Mona Hoffmann consideran nuevas perspectivas para Emma. Los efectos son más evidentes en la atrofia muscular espinal, pero Nusinersen representa un movimiento más amplio de la placa de Petri a la clínica. Las enfermedades hereditarias como la de Duchenne y la de Huntington ya no parecen insuperables. Si al final los principios activos no convencen, hay otros: moléculas pequeñas, fármacos antisentido y terapias génicas.
Varias cosas están en ensayos clínicos, algunas con señales iniciales positivas. A la larga, CRISPR podría tener lo que se necesita para marcar una gran diferencia. Todos estos ejemplos muestran que es posible ayudar a las células nerviosas y musculares. Y si puede hacer eso por una sola enfermedad, Ed Wild pensó que valía la pena el esfuerzo.
"Estas enfermedades son muy raras. Se podría decir que son terapias altamente especializadas para aplicaciones de nicho, no importa. Pero tengo una opinión completamente diferente al respecto. Estamos tomando estas enfermedades del campo de lo incurable al campo de posibles tratamientos. Y cada vez que hacemos eso, es una victoria para la humanidad".