¿Cuál crees que es el mayor logro del proyecto FAH?
Delemotte: El mayor logro es sin duda involucrar a tantas personas repartidas por todo el mundo en un proyecto de investigación tan grande que aporta nuevos conocimientos sobre numerosos sistemas médicos y farmacológicos. El tipo de cálculos que hacemos en nuestra investigación nos permite desarrollar nuevos fármacos y fármacos al mostrarnos gráficamente dónde se conectan los fármacos con sus objetivos y cómo funcionan. Sin embargo, tales cálculos son muy complejos.
En pocas palabras, la idea detrás de FAH es utilizar la potencia informática no utilizada de muchas computadoras en todo el mundo para simular la dinámica de las proteínas. Hablando en sentido figurado, cada simulación es una especie de explorador. Al enviar miles de ellos en todas las direcciones posibles, podemos abordar problemas que no se pueden resolver en una sola computadora.
Las aplicaciones biomédicas de la técnica FAH son muy amplias e incluyen enfermedades como el Alzheimer, el cáncer y el control de infecciones. Actualmente nos estamos concentrando en obtener una mejor comprensión del SARS-CoV-2. Con el proyecto COVID-Moonshot, participamos activamente en el desarrollo de agentes antivirales y ya hemos identificado los primeros candidatos. Se están finalizando las pruebas con modelos basados en animales. Actualmente estamos trabajando en la aplicabilidad humana. El objetivo es el desarrollo y producción de un fármaco antiviral libre de patente para administración oral. Esto fortalecería la protección contra nuevas variantes del SARS-CoV-2 en todo el mundo.
¿Cuál es el hito más importante del año pasado?
Delemotte: Diría que los científicos detrás de FAH están participando en "COVID Moonshot". El desarrollo de un nuevo ingrediente activo contra el Covid-19 se basa en las contribuciones de muchos equipos de investigación en todo el mundo. La FAH ha contribuido a ello con numerosos cálculos y simulaciones, y otros grupos están realizando experimentos de laboratorio a partir de ellos. Ya existen fármacos candidatos prometedores que esperamos sean desarrollados y probados.
¿Cuál es el mayor desafío en un proyecto de computación distribuida como este?
Delemotte: Aparte de los desafíos técnicos, para los cuales confío en otros miembros del consorcio FAH, supongo que es esto: explicar a los donantes de tiempo del procesador (y al público en general) que nuestra investigación es un esfuerzo largo y desordenado. Gran parte del progreso permanece invisible para los extraños y también sería difícil de explicar, pero es esencial para nosotros. No poder señalar un fármaco específico y decir: "¡Desarrollamos esto y ahora está salvando vidas!" hace que sea difícil mantener el interés durante largos períodos de tiempo.
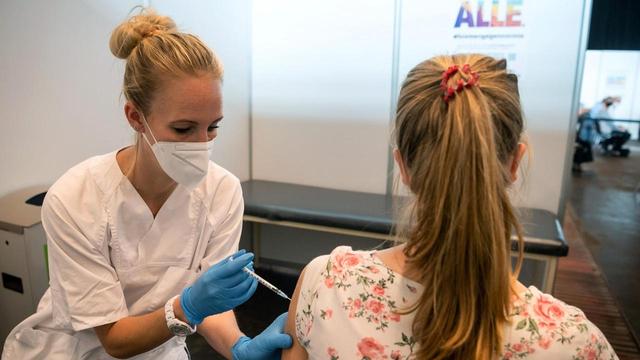
Según su leal saber y entender, ¿los hallazgos obtenidos por la FAH han contribuido al desarrollo de una vacuna contra el covid-19?
Delemotte: No, porque la FAH no participa en la investigación de vacunas; nuestros métodos no son particularmente adecuados para esto. El desarrollo y optimización de la vacuna tiene como objetivo estimular el sistema inmunológico del cuerpo para combatir el virus lo más rápido posible para que no infecte las células.
En cambio, nos estamos concentrando en una sola proteína del virus, la molécula objetivo (objetivo), y estamos tratando de interrumpir específicamente su función con sustancias activas. Estos pueden ser moléculas pequeñas o péptidos que forman un enlace fuerte y selectivo con el objetivo. Por ejemplo, ayudan a detener la multiplicación del virus; ese es el caso del ataque de proteasa viral, que es Project COVID Moonshot. O se dirigen a la proteína espiga del virus e interrumpen su unión a las células humanas y, por lo tanto, su entrada en las células. Con nuestro método, visualizamos si los candidatos a fármacos se unen a una proteína viral específica y en qué medida, y si realmente impiden su función. Esto nos da pistas de cómo podemos mejorar el principio activo.

Incluso antes del proyecto COVID, la FAH utilizó el tiempo de cómputo proporcionado por los participantes para investigar otras enfermedades como el Alzheimer, el Huntington o el cáncer. ¿Hubo algún éxito?
Delemotte: Sí, incluso algunos, por ejemplo con el virus del Ébola. Además, los investigadores descubrieron, por ejemplo, nuevos sitios sensibles para los medicamentos, los llamados "sitios farmacológicos" en varias bacterias, importantes en la lucha contra la resistencia a los antibióticos. Un problema en el desarrollo de fármacos es que a menudo solo hay una instantánea de cómo se ve una proteína. Pero las proteínas no son estáticas, tienen muchas partes móviles. Usando las simulaciones FAH, intentamos descubrirlos y usar los hallazgos para desarrollar nuevos métodos para atacar proteínas específicas con sustancias activas.
La resistencia a los antibióticos es un problema médico creciente, que cuesta decenas de miles de vidas y cantidades asombrosas de dinero cada año. Una de las formas más comunes de resistencia es que las bacterias infecciosas produzcan -lactamasa. Esta proteína descompone el antibiótico y protege a las bacterias.
Nuestras simulaciones de la -lactamasa mostraron que durante los movimientos normales de la proteína, una parte se abre y revela un bolsillo críptico que antes se desconocía. En experimentos posteriores, pudimos demostrar que moléculas que son muy similares a los productos farmacéuticos se deslizan en este bolsillo y se atascan allí, inhibiendo así la -lactamasa. En el futuro, queremos aplicar este método a moléculas que antes se consideraban intratables. [Nota del editor: una versión de acceso abierto de este trabajo se puede encontrar libremente.]
¿Cómo ve AlphaFold, el algoritmo para predecir estructuras de proteínas de DeepMind, subsidiaria de Google? ¿Es más un competidor o simplemente otra herramienta disponible para los científicos?
Delemotte: DeepMind ha dado un gran paso adelante en la predicción de estructuras de proteínas con el algoritmo AlphaFold; por lo tanto, han tomado la delantera en el campo. ¡Me gustaría felicitar al equipo! Sin embargo, AlphaFold no explica cómo se pliegan las proteínas; este es un fenómeno aún sin resolver. El algoritmo tampoco responde ninguna de las otras preguntas relacionadas directa o periféricamente con el plegamiento de proteínas.
Por el contrario, FAH originalmente se centró precisamente en esta pregunta: ¿Cómo se pliegan las proteínas para adoptar su estructura dominante? Mientras tanto, sin embargo, el proyecto también incluye otras preguntas relacionadas en su investigación, ya que todos estos fenómenos están sujetos a los mismos principios físicos. Las sinergias entre AlphaFold y Folding@home podrían ayudarnos en estos puntos.
¿Habrá nuevos proyectos en Folding@home?
Delemotte: Siempre hay nuevos proyectos en desarrollo. No se trata solo del Covid-19, sino también de otras áreas como los trastornos neurodegenerativos, las arritmias cardíacas, otras enfermedades virales o la distrofia muscular. Con más poder de cómputo, simplemente podemos hacer más investigación en todo tipo de áreas de la salud y la biotecnología.
Las GPU ahora brindan mucha más potencia informática que las CPU. ¿Pueden los procesadores clásicos seguir haciendo una contribución significativa a las simulaciones de FAH?
Delemotte: ¡Definitivamente! Hay dos motores para la tecnología de simulación que utilizamos: OpenMM se ejecuta en GPU, GROMACS en CPU. Cubren diferentes subáreas, por lo que ambos proporcionan datos útiles.
¿Qué métrica promete el rendimiento más alto cuando se pliega: alta potencia de cómputo FP32/FP64, ancho de banda de memoria, caché (tamaño, rendimiento, latencia) u otra cosa?
Delemotte: los procesadores y chips gráficos modernos y rápidos ofrecen el mejor rendimiento. Sin embargo, desde nuestro punto de vista, es más importante que la mayor cantidad posible de participantes nos donen tiempo de computación, incluso si no tienen el hardware óptimo. Podemos distribuir nuestros cálculos en muchas máquinas y luego juntar los resultados.