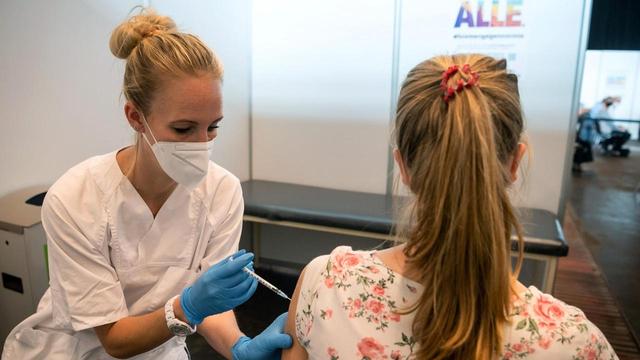
Dra. Claudia Weiß: "Sentimos claramente um espírito de otimismo." - Dr. Arpad von Moers: "E é claro que todo mundo quer." – Mona Hoffmann: "Ela está realmente melhor agora do que nunca. Claro, dada a idade dela, ainda é um pouco diferente de crianças saudáveis. Mas ela é perfeita do jeito que é." – Emma Hoffmann: "Emma Hoffmann."
Emma tem dois anos, conversando e brincando com seus pais Jan e Mona Hoffmann. Uma cena cotidiana, mas tudo menos evidente. Emma está presa a uma cadeira especial com encosto de cabeça e uma mesa. Ela não consegue manter a cabeça erguida por muito tempo e também mal consegue levantar os braços. "Bem, nós realmente notamos, por volta de cinco ou seis meses, que seus movimentos estavam ficando cada vez menores. Ela era capaz de se virar então. Isso praticamente parou durante a noite", diz Mona Hoffmann.
Atrofia muscular espinhal. Uma doença hereditária rara. O gene SMN1 é defeituoso. Ele orquestra a implementação da informação genética nas células nervosas da medula espinhal. Sem SMN1, os nervos morrem, os músculos não são mais controlados e atrofiam. Crianças com atrofia muscular espinhal tipo 1 nunca aprendem a sentar sem ajuda.
A maioria deles nem chega aos dois anos porque seus músculos pulmonares estão falhando. Graças à ajuda dos ventiladores, a expectativa de vida agora é maior. "Bem, isso me afetou mentalmente. Eu também caí em depressão e não conseguia lidar com isso", relata Mona Hoffmann.
Novas abordagens terapêuticas na atrofia muscular espinhal
O futuro: preto. Mas o presente é Emma, sua criança feliz. "Mais leite, mais água, coma você mesmo", diz Emma. Padre Jan Hoffmann diz: "Acima de tudo, ela sabe o que quer." Emma: "Coma leite, coma colher, derramou! Ajude a mamãe!"
Nenhum gene é convertido de um para um nas células humanas. Primeiro, cópias de trabalho dos genes são feitas e otimizadas de várias maneiras. Só então surge a proteína acabada.
Até o momento, não existe terapia genética real para a atrofia muscular espinhal de Emma. Mas no nível da cópia de trabalho, os pesquisadores encontraram uma alavanca. "Essa é uma conquista sensacional. Agora que as causas das doenças musculares foram esclarecidas por décadas, e agora pela primeira vez existem abordagens terapêuticas que realmente parecem trazer uma mudança no atendimento clínico dos pacientes."
O neuropediatra Janbernd Kirschner do University Hospital Freiburg concorda com seu colega Arpad von Moers da DRK Kliniken Westend em Berlim: Todo o campo das doenças nervosas e musculares hereditárias começou a se mover: "Agora aqui nesta área especial, na Significant já houve progresso na atrofia muscular espinhal e isso certamente se reflete em outras áreas."
Novas drogas também foram aprovadas para a distrofia muscular de Duchenne e estudos estão em andamento para a doença de Huntington. As terapias seguem abordagens muito diferentes e, no entanto, têm uma coisa em comum: elas ajudam o paciente a lidar com a doença apesar dos genes. Os preparativos levaram muitos anos, houve contratempos, os sucessos dos experimentos com animais não puderam ser repetidos em pacientes humanos. Mas nos últimos dois anos a maré parece estar virando.
Os pacientes e suas famílias já sonham com a cura, embora ainda não haja experiência de longo prazo, explica von Moers: "Tudo leva vários anos para passar por todos os processos de estudo. E, portanto, você sempre tem que ter esperança e os fatos lado a lado."
Nova droga dá esperança
Nusinersen. Disponível na Alemanha desde janeiro de 2017 para o tratamento de crianças com atrofia muscular espinhal. Pertence às drogas antisense. As sequências genéticas curtas correspondem a cópias funcionais do gene SMN2, um gene SMN1 interrompido que é irrelevante em indivíduos saudáveis. Nusinersen pode colocar a cópia de trabalho do SMN2 em funcionamento novamente. Não é uma solução perfeita, mas é produzida proteína SMN suficiente para alimentar os nervos e manter a força muscular.
"Foi observado que os pacientes tratados com este medicamento desenvolveram habilidades motoras significativamente melhores do que os pacientes do grupo placebo", relata von Moers, que recebeu apenas um medicamento simulado. Esse tratamento desigual não era mais eticamente justificável. O estudo foi interrompido em 2016 e a aprovação foi solicitada. Nusinersen já está disponível nos EUA. Na Europa, os procedimentos ainda estão em andamento, mas existe um programa para crianças particularmente atingidas.
Droga engenhosa?
Ryan Collin está deitado em uma cama na unidade de terapia intensiva neonatal da DRK Kliniken Westend. Ele tem oito meses, muitos dos quais passou no hospital. Ryan também sofre de atrofia muscular espinhal. Seus músculos pulmonares são afetados. Ele é ventilado por um corte na traquéia, ele recebe seu leite por um tubo estomacal. "Ele está sempre de bom humor, não importa o que aconteça, ele sempre sorri para nós", diz sua mãe Jeannette Wonsik. "E é assim que sabemos que estamos tomando as decisões certas para ele. Ele nos dá esperança, o homenzinho."
Ryan está no programa de dificuldades, ele recebe Nusinersen. Para que a droga realmente alcance os nervos da medula espinhal, ela deve ser apontada para lá. No entanto, Jeannette Wonsik não hesitou: "Então, no início, dissemos, o que ainda temos a perder? Vamos tentar."
A injeção na medula espinhal é rotina para a médica de Ryan, Manuela Theophil. Ela garante um ambiente estéril, monitora a respiração e a circulação e dá um sedativo a Ryan para que ele não se mova: "O procedimento real é que você puncione o canal espinhal abaixo da medula espinhal, para que a medula espinhal não seja afetada e não seja ferido Este é o procedimento.
Também não ocorreram efeitos colaterais com Ryan. “Ele está bem, agora está abrindo as mãos, mexendo bem, brincando um pouco com o celular”, conta a mãe. "Tente virar a cabeça para frente e para trás e também mover as pernas para cima. E acho incrível que uma droga tão simples possa trazer tanto movimento."
Theophil relata: "Os pais que vêm para a segunda, terceira ou múltiplas doses, eles o cumprimentam com um sorriso. E se o medicamento cumpre o que promete, é um medicamento engenhoso. Vamos ver o que o tempo traz. "
Medicação disponível apenas para casos difíceis
O programa hardship cobre apenas as formas graves de atrofia muscular espinhal tipo 1. Existem variantes mais brandas, onde as crianças também perdem gradualmente a força, só que mais tarde e de forma mais gradual. Nusinersen provavelmente também ajudará você, mas essas crianças ainda não podem obtê-lo na Alemanha.
"É muito difícil para os pais suportarem", diz Arpad von Moers. "Especialmente em combinação com a impressão de que quanto mais cedo melhor o sucesso do tratamento. Alguns estão desesperadamente desesperados, alguns também ameaçaram com ação legal porque seu filho está sendo negado tratamento. Há, por assim dizer, todo o espectro de casos mais agressivos mas acima de tudo, reações desesperadas."
"Você pode dizer se não consegue acompanhar"
Sebastian Fedder sofre de distrofia muscular de Duchenne (Deutschlandradio / Volkart Wildermuth )
Hóquei em cadeira de rodas. Em campo, os jogadores correm a dez quilômetros por hora, viram na hora na velocidade da luz, bloqueiam o caminho do adversário. Para Sebastian Fedder, treinar no Rocky Rolling Wheels em Hohenschönhausen é o ponto alto da semana: "E é claro que você pode competir. Eu costumava fazer outras coisas quando estava um pouco mais em forma. Mas um esporte como esse, que é realmente feito sob medida para você, é algo especial. E eu sempre gostei de hóquei e há muito disso, então foi muito divertido e realmente fascinante.
Sebastian Fedder está preso em sua cadeira de rodas. À direita ele ainda tem força suficiente para segurar o bastão, a mão esquerda controla por meio de um pequeno joystick. Ainda.
Distrofia muscular de Duchenne. Uma forma de perda muscular hereditária. Conheça um em cada 3.500 meninos. Causa: uma variedade de diferentes defeitos no gene da distrofina. A distrofina é importante para a estabilidade e transmissão de energia nas células musculares. As meninas têm duas cópias do gene e, portanto, raramente ficam doentes. Meninos com uma mutação de distrofina primeiro se tornam desajeitados e depois incapazes de andar. Gradualmente, mais e mais grupos musculares falham. Na idade adulta jovem, a respiração e os músculos cardíacos também falham.
"Você mesmo percebe quando não consegue acompanhar outras pessoas da mesma idade", diz Fedder. "Claro que está sempre no quarto. E claro que também significa que você está quebrado às vezes. Mas bem, nessa idade outras pessoas podem ter outros problemas. Você nem sempre está de bom humor."
Sebastian Fedder tem 27 anos. Nem todos os pacientes vivem tanto tempo. O fator decisivo é onde e de que maneira o gene da distrofina é modificado. As possibilidades são muitas, afinal é o maior gene humano conhecido, Sebastian Fedder tem uma mutação pontual, apenas uma das 2,5 milhões de letras genéticas está errada.
"Essa mudança significa que um sinal de parada aparece muito cedo e a produção da proteína é interrompida prematuramente", explica o Prof. Janbernd Kirschner, médico sênior da Clínica de Neuropediatria e Doenças Musculares do Hospital Universitário de Freiburg. E assim foram desenvolvidas drogas especiais que cobrem esse sinal de parada - você poderia dizer figurativamente - e levam ao fato de que a proteína pode ser produzida por completo."
A companhia de seguros de saúde aprova uma tentativa de terapia individual
Atalura. Uma pequena molécula que ajuda a célula a ignorar o sinal de parada errado no gene da distrofia. Isso não acontece com todos os processos de leitura, mas com uma parte significativa. Em um estudo, os participantes do teste inicialmente não mostraram melhora. A longo prazo, no entanto, a droga parece ter um efeito positivo. Ataluren foi aprovado provisoriamente na Europa desde 2014 até que um estudo maior traga resultados claros. As autoridades americanas ainda hesitam.
"Em seguida, lemos sobre isso e depois perguntamos sobre isso e simplesmente solicitamos à companhia de seguros de saúde como um tratamento individual ou tentativa de terapia", diz Fedder. "E então, devo dizer a mim mesmo, sinceramente não esperava, eles aprovaram."
Jan Fedder estava eletrizado. Ataluren destina-se apenas a doentes com mais de cinco anos de idade e que ainda possam andar. Sebastian Fedder, por outro lado, já está em uma cadeira de rodas. Mas a neuropediatra Claudia Weiß, do Berlin Charité, está comprometida com ele: “No caso deste paciente, também escrevi à companhia de seguros de saúde que, com base no mecanismo de ação e nos dados iniciais que ainda não foram publicados, faz faz sentido tratar esses pacientes também, a fim de manter a força do braço e a função pulmonar pelo maior tempo possível." Mesmo no caso de um menino de três anos, muito jovem para o tratamento Ataluren, Claudia Weiß conseguiu convencer a seguradora. A burocracia é alta.
"Você tem que dizer muito claramente que não vai ficar em forma novamente com isso. Mas o progresso deve ser evitado", explica Fedder. "E tenho a sensação de que isso fará algo por mim. E então eu seria um pouco mais ativo no clube esportivo e treinaria um pouco lá. E estou ansioso por isso."
Estudos com um grande número de pacientes impossíveis
Não há pacientes para estudos significativos - as doenças genéticas são muito raras (dpa/picture-alliance/Waltraud Grubitzsch)
No caso de um único paciente, os efeitos dificilmente podem ser comprovados objetivamente. Mas Sebastian Fedder involuntariamente fez uma pequena experiência. Certa vez, ele ficou inesperadamente atrasado em uma viagem e teve que pular uma dose de ataluren como resultado. "E devo dizer que pelo menos tive a sensação de que tudo foi um pouco mais difícil e não funcionou tão bem, o que ainda posso fazer sozinho."
Quando se trata de um novo medicamento para diabetes, os estudos são realizados com centenas, às vezes milhares, de pacientes. Isso simplesmente não é possível com as raras doenças hereditárias. Às vezes, apenas algumas dezenas de pacientes recebem o novo medicamento aqui. Claudia Weiß: "Esse é um problema muito grande. Isso não é suficiente para cobrir o espectro de efeitos colaterais. Isso não é suficiente para realmente poder dizer algo sobre a eficácia em um grande número de pacientes."
A distrofia muscular de Duchenne só recentemente mostrou como é difícil avaliar a situação de forma realista. Uma droga convenceu em experimentos com animais, mesmo com os primeiros pacientes parecia fazer efeito. No final, porém, nenhum efeito pôde ser detectado. Von Moers: "Ainda não existe um caminho de ouro, você tem que olhar de novo e de novo: que risco estamos correndo, que risco estão correndo as famílias? E certamente sempre haverá situações na área de doenças raras em que você só precisa tomar uma decisão. Ok - estamos fazendo isso agora sem ter uma situação de dados muito, muito segura."
Novos conceitos prontos para uso em pacientes
As terapias genéticas clássicas até agora conseguiram pouco na área de doenças musculares hereditárias. Agora existem abordagens mais flexíveis: drogas antisense e outros agentes para resgatar cópias de trabalho genéticas defeituosas. Relatórios recentes de sucesso mostram que os conceitos estão prontos para uso em pacientes.
No entanto, um problema muito fundamental permanece com a distrofia muscular de Duchenne: o ataluren e outra droga aprovada nos EUA potencialmente ajudam cerca de um quarto dos pacientes. O resto tem outras mutações no gene da distrofina, algumas das quais só aparecem em um punhado de pessoas. É praticamente impossível desenvolver medicamentos clássicos para grupos tão pequenos.
Para eles, o novo vislumbre de esperança é: CRISPR Cas. A abreviação esconde uma ferramenta que os pesquisadores copiaram de bactérias. Consiste em duas partes: uma tesoura para o material genético e uma pequena molécula que diz à tesoura por onde começar. Os engenheiros genéticos desenvolveram o CRISPR em um bisturi de alta precisão para operações em material genético.
Geneticista Cohn: Lágrimas quando a terapia é bem-sucedida
"Um dia saiu um artigo em uma revista inglesa, o Daily Telegraph, que falava sobre como essa mudança revolucionária é essa tecnologia. E no dia seguinte recebi mais de 30 e-mails de pais de meus pacientes. E isso é quando decidi transformar completamente a pesquisa em meu laboratório." O geneticista Roland Cohn se especializou em CRISPR.
No "Hospital for Sick Children" em Toronto, no Canadá, ele conseguiu usar o novo método para corrigir vários defeitos genéticos em células de pacientes com Duchenne, incluindo um tipo de gagueira no gene da distrofina que dificulta a informação genética para ler: uma Duplicação, ou duplicação, como dizem os geneticistas, "A primeira vez que vi que removemos a duplicação de um de nossos pacientes, na verdade o filho de bons amigos meus, e obtivemos a proteína distrofina completa, é Foi um momento muito emocionante para mim. Chorei quando vi a foto."
Exatamente porque os grupos de pacientes são tão pequenos, existe um vínculo mútuo muito próximo com os pesquisadores. Isso motiva, mas também põe em risco a objetividade. "Temos uma reunião em nosso laboratório a cada poucos meses, onde falamos sobre as complicações éticas de nossa pesquisa e também garantimos, por exemplo, que não nomeamos mais as células dos pacientes com as quais trabalhamos, mas apenas nomeamos números, para levar um pouco do lado pessoal da ciência e também para diminuir um pouco a pressão sobre os cientistas que trabalham no meu laboratório e sobre mim."
Pacientes como cobaias?
CRISPR corta de forma confiável na placa de Petri. Atualmente, estão sendo realizados experimentos com camundongos nos quais foram simuladas mutações individuais de Duchenne. Os animais adoecem como os humanos. "E estamos agora no processo de tratar esses camundongos com as construções CRISPR. Portanto, posso dizer que todos esses são resultados preliminares, ainda não terminamos, mas tudo parece muito promissor".
A aplicação humana ainda está a anos de distância. Sebastian Fedder não tem grandes esperanças de que o CRISPR o beneficie. "Portanto, é sempre a pergunta: quando você chega lá? Se você chega relativamente cedo - não quero usar a palavra cobaia agora - mas no final é em parte assim."
Especialmente quando se trata de mutações muito raras de Duchenne, conceitos de estudo completamente novos teriam que ser desenvolvidos para possíveis terapias CRISPR. Especialmente porque é duvidoso que funções que já foram perdidas possam ser recuperadas dessa maneira. Talvez em algum momento seja possível estabilizar pelo menos as habilidades particularmente importantes em pacientes mais velhos como Sebastian Fedder. Por exemplo, a mobilidade da mão para controlar a cadeira de rodas.
Roland Cohn: "Conheci um grupo de pacientes mais velhos de Dychenne em novembro, todos com mais de 20 anos, e foi uma experiência incrível para mim quando eles me disseram: Contanto que eu ainda consiga mover minha mão ou braço seria o suficiente para mim. É claro que todo mundo quer se levantar e andar de novo. Mas acho que pacientes diferentes em idades diferentes têm desejos diferentes, falando realisticamente agora."
Fedder responde: "É importante para mim e eu ficaria feliz se realmente saísse uma droga onde você pudesse dizer: o progresso é completamente interrompido ou talvez até as funções retornem. Mas se não for assim, você não pode mudar e então ainda prefiro me concentrar nas coisas que ainda posso fazer e não enlouquecer."
"Mesmo que seja apenas minha imaginação, é incrível!"
"Finalmente começou uma semana depois, depois que ela fez a punção, começamos a notar uma mudança. Ela ficou um pouco mais ativa com os braços. Mesmo que seja só minha imaginação, é incrível!", relata Mona Hoffmann, Emma's mãe. "Para onde ele foi? Lá está ele" Para onde ele foi? Bola, oh, caiu. Onde ele foi? Obrigado. Obrigado, isso também."
"São situações que não seriam possíveis sem medicação, que só temos força para jogar a massa. Mesmo que não seja longe, há um progresso claro", diz o pai, feliz, Jan Hoffman.
"Não podemos dizer no momento se isso levará a um desenvolvimento normal ou quase normal das crianças", explica a neuropediatra Claudia Weiß. "Não é muito provável, para ser honesto. Mas pelo menos esperamos que o curso da doença seja muito mais brando."
Triagem neonatal para atrofia muscular?
Os recém-nascidos já são examinados no hospital - aqui está um teste de audição (imagem central do dpa)
Claudia Weiß espera que, graças a Nusinersen, mais crianças como Emma aprendam a sentar-se de forma independente, talvez até a ficar em pé, apesar de sua atrofia muscular espinhal. Os músculos respiratórios podem se tornar mais fortes e, portanto, ter uma vida útil mais longa. Tudo isso é agora: esperança. Mas a esperança inspira pais e médicos. Ninguém sabe se Nusinersen pode manter a doença sob controle a longo prazo. Mas os estudos mostraram uma coisa, enfatiza Arpad von Moers:
"Quanto mais cedo melhor. Isso significa que os pacientes que iniciam o tratamento muito cedo provavelmente se beneficiarão mais do que aqueles que começam mais tarde. E há um grupo tão pequeno de pacientes que foram tratados desde o nascimento E esse grupo está se desenvolvendo surpreendentemente bem em comparação com as crianças que conhecemos com atrofia muscular espinhal."
Essas crianças eram consideradas de risco porque seus irmãos mais velhos já tinham a doença. Na maioria das vezes, no entanto, ocorre inesperadamente. Muito tempo é perdido antes que os sintomas sejam perceptíveis. "Isso significaria, em perspectiva, que seria preciso considerar a inclusão da atrofia muscular espinhal em uma espécie de triagem neonatal", ressalta Weiss.
"É um pré-requisito importante que seja uma doença que pode ser decisivamente influenciada pelo tratamento precoce", diz von Moers. "E isso realmente cumpre o critério mais importante para poder implementar esse aspecto, quanto mais cedo melhor o sucesso."
Triagem neonatal. No terceiro dia de vida, uma gota de sangue é coletada para procurar indícios de 13 doenças tratáveis: fenilcetonúria, hipotireoidismo e, desde 2016, também fibrose cística.
US$ 125.000 para uma injeção
Se o que Nusinersen promete hoje se confirmar, então Claudia Weiß e Arpad von Moers podem imaginar que a atrofia muscular espinhal será o número 14 aqui. Mas então as crianças teriam que receber a droga anti-sentido por muitos anos. E isso vai custar caro. O fabricante Biogen cobra $ 125.000 por uma injeção nos EUA. No primeiro ano, isso soma três quartos de milhão por criança, e a dose de manutenção mais tarde deve custar a metade disso. Neuropediatra Janbernd Kirschner: "É claro que o número de pacientes tratados é relativamente pequeno e, no entanto, os custos de desenvolvimento são imensamente altos. Portanto, é inevitável que os preços por paciente também sejam bastante altos. "
Em última análise, apenas as empresas sabem como os custos e os lucros realmente se relacionam. "Até agora, não acho que seja realmente um problema para o sistema de saúde, especialmente se você colocar isso em relação a outros custos que surgem no sistema de saúde", diz Kirchner. "Mas é claro que, se esses medicamentos forem desenvolvidos para cada vez mais doenças raras, os custos gerais também poderão aumentar aqui."
A "mais curável das doenças cerebrais incuráveis"
Doença de Huntington. Com esta doença hereditária, os pacientes primeiro se tornam desajeitados em seus 30 ou 40 anos, então seus membros começam a se contrair involuntariamente até ficarem presos em uma postura, às vezes por horas. Os sintomas tornam-se cada vez mais graves e os afetados morrem dentro de dez a 20 anos. A doença é herdada de forma dominante. Isso significa que cada paciente pode ver de um pai o que esperar.
"Sou um otimista nato. Mas há boas razões para ser otimista em relação à DH." Edward Wild, um neurologista da University College London, certa vez descreveu a doença de Huntington em um artigo como "a mais curável das doenças cerebrais incuráveis". Ao contrário do Alzheimer ou do Parkinson, a causa do Huntington é conhecida há mais de 20 anos: uma alteração em um gene no cromossomo 4, que transforma a proteína dele derivada em um veneno para as células nervosas.
Ionis HTTPRx. Este medicamento anti-sentido liga-se à cópia de trabalho do gene da DH e faz com que seja decomposto pelas células. Muito menos proteína tóxica é produzida e os nervos sobrevivem. Semelhante ao Nusinersen, o HTTRx precisa ser injetado no fluido espinhal. Experimentos em animais mostram que a droga pode interromper a progressão dos sintomas e, em alguns casos, até mesmo revertê-los.
"Demos as primeiras injeções aos pacientes em setembro de 2015", relata Wild. "Durante esses 18 meses, as dosagens foram aumentadas várias vezes sem nenhum efeito colateral. Estamos dando uma droga que afeta a atividade dos genes no cérebro. O fato de não haver problemas significativos aqui é realmente um importante passo à frente."
O estudo decorrerá até ao final de 2017. Só então ficará claro se o HTTRx também funciona no cérebro humano e se tem impacto nos distúrbios do movimento.
Criando novas perspectivas
Mona Hoffmann: "Ela está definitivamente mais forte, um pouco mais ativa com a função do braço. Ela agora pode segurar uma colher um pouco mais, o que ela simplesmente não conseguia fazer antes. Mexer no copo também funciona muito bem e bater em alguma coisa com o item ajuda mãe." Seu marido, Jan, diz: "A esperança é sempre muito difícil. O que você espera? Que a qualidade de vida seja melhor do que sem medicação. Que sua expectativa de vida aumente significativamente e que quando ela crescer em algum momento ela também participe corretamente na vida pode."
Jan e Mona Hoffmann consideram novas perspectivas para Emma. Os efeitos são mais evidentes na atrofia muscular espinhal, mas Nusinersen representa um movimento mais amplo da placa de Petri para a clínica. Doenças hereditárias como as de Duchenne e Huntington não parecem mais insuperáveis. Se os ingredientes ativos não convencem no final, existem outros: pequenas moléculas, drogas antisense e terapias gênicas.
Várias coisas estão em ensaios clínicos, algumas com sinais iniciais positivos. A longo prazo, CRISPR pode ter o que é preciso para fazer uma grande diferença. Todos esses exemplos mostram que é possível ajudar as células nervosas e musculares. E se você pode fazer isso para apenas uma doença, Ed Wild achou que valia a pena o esforço.
"Essas doenças são muito raras. Você poderia dizer que são terapias altamente especializadas para aplicações de nicho, não importa. Mas eu tenho uma opinião completamente diferente sobre isso. Estamos tirando essas doenças do campo do incurável para o campo de possíveis tratamentos. E cada vez que fazemos isso, é uma vitória para a humanidade."